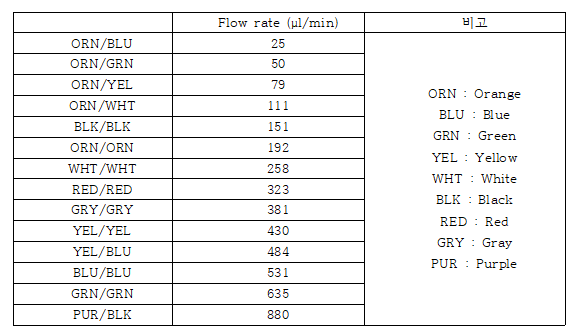
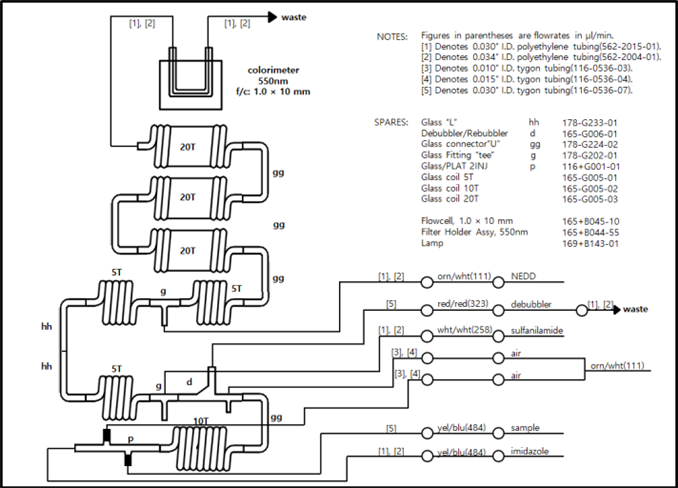
Chapter 3 기체분절 자동영양염 분석기를 이용한 해수 중 용존 아질산이온 분석 표준운영절차서
3.1 목적 및 범위
이 표준운영절차서는 해수 중 용존 아질산이온 농도를 안정적으로 저농도까지 분석하기 위해 기체분절 연속흐름법(gas-segmented continuous flow analysis method)의 기기 중 하나인 SEAL사 QuAAtro Stystem의 Q-035-04 Rev.7(multitest MT3B) 분석법을 해양과학기술원에서 변형한 방법에 관한 내용을 중심으로 측정원리, 분석준비, 분석과정 및 분석 후 자료처리 등을 포함한다.
3.2 측정 원리
해수 중의 아질산이온은 산성 조건하(pH<2)에서 일차적으로 방향족 질소화합물인 술퍼닐아미드(Sulfanilamide)와 반응하여 디아조늄이온(디아조화합물)을 형성한 후 이차적으로 디아조 화합물이 다른 방향족 질소화합물인 나프틸 에틸렌디아미드(NEDD)와 반응하여 붉은 보라색을 띠는 아조화합물을 생성한다. 아조화합물의 최대흡수 파장은 543 nm이다. 1 nm 간격으로 파장을 분리할 수 있는 분광광도계를 사용할 때 최대 흡수 파장인 543nm에서 흡광도를 측정한다. 여과기(filter)를 사용하여 단일파장의 빛을 flowcell로 주사하는 자동분석기는 사용하는 여과기의 특성에 따라 최대흡수 파장과 유사한 파장의 빛을 주사하여 흡광도를 측정할 수 있다. QuAAtro system에서는 550 nm 빛을 주사하여 흡광도를 측정한다. 시료의 아질산이온 농도 결정은 농도를 알고 있는 서로 다른 몇 개의 검량선용 표준용액열 (calibration standards)의 흡광도를 측정하여 농도-흡광도의 선형회귀 분석을 통하여 검량선을 작성하여 시료의 흡광도를 검량선에 대입하여 시료의 아질산이온 농도를 결정한다. 이 방법의 정량범위는 저농도는 0~10 μmol NO2-/L, 검출한계는 0.02 μmol NO2-/L이다. QuAAtro system을 이용한 자동분석법의 검출한계는 해양환경공정시험법에 제시된 검출한계인 0.214 μM보다 훨씬 낮아 해양환경공정시험법의 대체로 적절한 것으로 판단된다. 하지만 실험실별 기기의 운영조건이나 능력이 차이가 나기 때문에 해양환경공정시험법을 대체하려는 실험실에서는 검출한계에 대한 자료를 제시하여야 한다.
3.3 방해물
해수 중에 용존 된 황화수소 농도가 0.1 mg S/L 이상인 경우 카드뮴 환원관내에 침전물을 형성하여 아질산이온 분석을 간섭할 수 있다. 시료 중 황화수소는 카드뮴 또는 구리염을 제거하는 방법으로 반드시 제거되어야 한다. 해수 중 용존 철, 구리 및 기타 중금속 농도가 1 mg/L 이상인 경우 카드뮴 컬럼의 효율을 저하 시킬 수 있다. EDTA를 첨가하여 이들 금속 이온들과 착화합물을 형성시켜 이들 금속이온들의 영향을 최소화한다. 탁도가 높은 시료는 시료를 여과한 후 분석한다. 여과 시 약 50 mL의 시료를 여과지에 통과시켜 먼저 여과지를 세척한 다음 추가적으로 시료를 여과하여 시료 용기를 세척한 후 필요한 시료량 만큼 해수를 여과한다. 이전 시료가 저농도 또는 고농도일 경우, 잔류영향 (carryover effect)을 보정하도록 시료 목록을 구성하여 분석프로그램에서 자동적으로 보정할 수 있도록 한다. 잔류영향을 보정하기 위한 시료목록 작성에 대한 내용은 기기에서 제공되는 시료목록작성 매뉴얼을 참고한다. 만약 자동적으로 보정을 원하지 않을 경우에 수동적으로 보정해야 하고 이를 위한 방법은 부록에 제시된 방법대로 시료를 분석하여 보정한다.
3.4 기구 및 기기
해수 중 아질산이온 분석에는 필요한 기구 및 기기는 유리 또는 플라스틱 재질의 부피정량기구(4.1), 시약, 시료, 검정곡선용 표준용액 등을 보관하는 용기(4.2), 시약 또는 검량선용 표준물질 제조 시 무게를 측정하는 저울(4.3), 부피정량을 위한 피펫(4.4), 그리고 분석기기인 QuAAtro system(4.5)이다. 실험에 사용되는 모든 초자류는 10% 염산으로 씻은 후 초순수로 3회 헹구어 사용한다. 분석기기의 구성과 사용법은 부록에서 자세하게 다루고자 한다.
3.4.1 부피정량 기구
부피플라스크는 일반적으로 NIST Class A 또는 이에 상응하는 성능으로 일반적으로 표시된 부피의 0.05% 이하의 불확도를 가져야 한다. 부피정량에 사용되는 유리 또는 플라스틱 재질의 기구는 무게 법으로 부피보정을 실시하여야 한다. 특히 플라스틱 재질의 기구는 사용되는 실험실 온도의 2-3K 범위내로 보정된 것을 사용하여야 한다. 붕규산 재질의 부피플라스크의 온도가 부피에 미치는 영향은 잘 알려져서 보정 시 사용된 온도로부터 일반적인 실험실에서 기구가 사용될 때 온도에 의한 부피를 쉽게 계산할 수 있다(Kolthoff et al., 1969; Weast, 1985). 따라서 유리재질이 열팽창에 우수한 성능을 보이고 증류수를 사용하면 거의 녹지 않기 때문에 일반적으로 많이 이용된다. 하지만 해수 분석에서 검정곡선용 표준용액열을 제조를 위해서 유리재질의 부피플라스크에 저영양염 해수 또는 인공해수로 희석할 때 규산이 녹아 나올 수 있어 유리재질 부피플라스크 사용이 제한된다. 일반적으로 사용되는 플라스틱은 polymethylpentene (PMP), polypropylene(PP)등의 고품질의 재질이 사용되고 화학적으로 내구성이 강한 테프론 재질이 사용되기도 한다. 특히 검량선용 표준용액열의 농도는 무게로 보정된 부피를 사용한다. 보정되지 않은 플라스틱 재질의 부피정량 기구를 사용하면 3%이상의 누적 불확도를 일으킬 수 있다.
3.4.2 보관용기
다른 용존 영양염 항목과 함께 용존실리카 분석을 병행한다면 미량이지만 용존실리카가 용출될 수 있으므로 공통적으로 사용되는 모든 시료병과 시약병 및 시험관 등은 반드시 플라스틱(예: HDPE, PP) 재질을 사용하기를 권장한다. 분석에 사용되는 모든 시약 용기는 반드시 10% 염산 용액(5.1.5.1 참고)으로 씻은 후 초순수로 3회 이상 헹군 후 사용한다. 그리고 단단히 밀봉하여 시약별 보관 방법에 따라 보관한다.
3.4.3 저울
표준원액 제조 시 분해능 0.01 mg 이상의 저울을 사용하고 표준용액열 제조 시 분해능 0.001 g 이상의 저울을 사용하여 제조하는 표준용액열의 농도를 일정하고 정확하게 유지한다.
3.4.4 피펫
시료 및 시약을 분주할 때 가능한 정밀도가 높은 디지털피펫과 교차오염을 방지하기 위해 일회용 피펫 팁을 사용하는 것을 권장한다. 피펫의 경우는 보정 허용오차가 0.1%보다 좋은 것을 사용해야 하며 일정한 온도와 습도조건 하에서 증류수의 무게로 실제 부피를 보정해야 한다. 특히 검정곡선용 표준용액열을 제조하기 위해 고농도의 표준원액을 분취하는데 피펫이 많이 사용된다. 분취된 표준원액 부피의 정확도에 따라 검정곡선 기울기가 변하므로 측정값의 정확도와 정밀도 향상을 위해 표준원액 분취에 사용되는 피펫의 정확도와 정밀도가 아주 중요하다. 피펫을 사용하는 실험자의 숙련도가 분취되는 양의 정확도와 정밀도를 결정한다. 실험자에 따라 피펫으로 용액을 흡입/배출 속도, 용액의 흡입 및 배출시 피펫의 기울기, 피펫팁이 용액에 담기는 깊이 등이 차이가 나다. 또한 피펫 팁 내벽상태, 용액과 실험실 온도와 습도 등의 영향을 많이 받는다. 피펫을 이용하여 옮겨야 할 부피에 대해서 실험자에 따른 정확도와 정밀도를 확인하여 실험자의 숙련도에 따른 오차를 반영하여 옮겨진 부피를 보정한다. 실험자에 따라 피펫을 이용하여 옮겨진 부피의 불확도를 줄이기 위해서 용액을 흡입/배출할 때 속도를 일정하게 조절할 수 있는 전동피펫 사용을 권장한다. 또한 피펫의 각도를 일정하게 유지하기 위하여 전동피펫을 평면에 대해 수직으로 고정하고 옮기는 용액을 일정한 깊이에 넣어 흡입한 다음 옮겨지는 용기를 고정된 피펫 아래로 가져와 배출한다.
3.5 시약제조
아질산이온 분석에 사용되는 시약은 크게 시스템관리용 시약(5.1), 발색시약(5.2), 표준용액(5.3) 등으로 구분한다. 시약 제조는 특성에 따라서 제조 후 장기간(수개월) 보관할 수 있는 시약과 분석 직전에 제조해야 하는 당일 제조 시약(daily)으로 분류된다.
사용되는 시약목록
| 이름 | 분자식 | CAS/Lat | 비고 |
|---|---|---|---|
| Sulfanilamide | \[C_6H_8N_2O_2S\] | 63-74-1 | 발색 |
| NEDD | \[C_{12}H_{14}N_2 \cdot 2HCl\] | 1465-25-4 | 발색 |
| Hydrochloric acid | \[HCl\] | 7647-01-0 | 발색 |
| Imidazole | \[C_3H_4N_2\] | 288-32-4 | 발색 |
| Copper Sulfate | \[CuSO_4 \cdot 5H_2O\] | 7758-99-8 | 발색 |
| Sodium Nitrite | \[NaNO_2\] | 7632-00-0 | STD |
| Sodium hydrogen carbonate | \[NaHCO_3\] | 144-55-8 | ASW |
| Sodium chloride | \[NaCl\] | 7647-14-5 | ASW |
| Triton X-100 | \[(C_2H_4O)_n C_{14}H_{22}O\] | 9002-93-1 | Wash |
3.5.1 시스템 관리용 시약
시스템 관리용 시약은 분석장비를 운용하고 유지·관리하는데 사용되는 기본시약으로 시약을 제조하는데 필요한 초순수(5.1.1), 표준용액열 희석용 인공해수(5.1.2), 기기동작 준비 및 분석완료 후에 사용되는 세척용액(5.1.4, 5.1.5) 등이 있다.
3.5.1.1 초순수(Ultra Pure Water, UPW)
초순수는 수돗물을 역삼투필터(Reverse Osmosis Membrane, RO membrane)를 통과시킨 후 이차로 초순수 제조기의 이온교환수지를 통과시켜 이온을 추가로 제거하여 전기저항값이 18.2 MΩ 이상인 탈이온수이다. 원수를 처음으로 걸러주는 전처리 필터는 역삼투필터나 이온교환수지의 수명과 효율에 영향을 주기 때문에 필터의 색을 지속적으로 확인하고 짧은 주기로 교체한다. 역삼투필터나 이온교환수지는 초순수의 전기저항값이 18.2 MΩ이 정상적으로 나타나더라도 장비에 따라 주기적(분기별)로 점검 및 교체한다. 농도가 낮은 시료의 용존실리카 분석값이 음의 값일 경우 표준용액열 및 각종 시약제조에 사용된 초순수의 용존실리카 바탕값이 높을 가능성이 있으므로 역삼투필터와 이온교환수지를 더 짧은 간격으로 교체한다. 순도 높은 초순수 제조를 위해서는 유기물 및 박테리아 제거를 위한 램프와, 이온교환수지를 보완할 전기탈이온장치(Electrodeionization module, EDI module)를 추가로 설치하는 것을 권장한다.
3.5.1.2 인공해수(Artifical Seawater, ASW)
인공해수는 표준용액열을 제조할 때 표준원액을 희석하는데 사용된다.
- Sodium chloride (NaCl) - 35 g
- Sodium hydrogen carbonate(NaHCO3) - 0.5 g
- 1000 mL 플라스틱재질 부피플라스크(용존실리카를 동시분석 할 경우)에 Sodium chloride 35 g, Sodium hydrogen carbonate 0.5 g을 초순수 약 800 mL에 완전히 용해시킨 초순수를 추가하여 1000 mL까지 맞춘다.
3.5.1.3 50% Triton X-100 용액
Sigma사의 Triton X-100 용액을 Isopropanol로 50:50으로 희석하여 제조한다. 전체 사용량을 고려하여 최종부피를 결정하여 제조한다. 해양과학기술원 분석실에서는 한 번에 약 100 mL를 만들어 1주일 정도 사용한다.
- Triton X-100 (Sigma) - 50 mL
- Isopropanol or Ethanol - 50 mL
- Triton X-100 50 mL와 Isopropanol(혹은 Ethanol) 50 mL를 100 mL 병에 넣어 완전히 혼합한다.
3.5.2 발색시약 (Color Reagents)
해수 중 아질산이온과 반응하여 디아조화합물을 형성하는 술퍼닐아미드, 디아조화합물과 이차 반응하는 나프틸 에틸렌디아미드 등 발색반응에 직접 관여하는 시약, 반응을 촉진하는 촉매, 반응조건 유지, 다른 이온들의 반응을 억제하여 감도를 증가시키는 역할 등을 수행하는 시약들이다.
3.5.2.1 Sulfanilamide
- Sulfanilamide(C6H8N2O2S) - 5 g
- 염산(HCl) - 50 mL
- 50% Triton X-100 (5.1.2) - 1 mL
- 500 mL 부피플라스크에 초순수 약 300 mL를 넣고 진한 염산 50 mL를 넣은 후 미리 무게를 측정해둔 Sulfanilamide 5 g을 첨가하여 완전히 용해시킨다.
- 이후 초순수를 부피플라스크의 500 mL 눈금까지 첨가하여 맞고 50% Triton X-100(5.1.3) 1 mL를 첨가한다.
- 반드시 초순수를 300 mL 부피플라스크에 먼저 넣고 진한 염산 50 mL를 넣어야 한다. 시약을 빨리 녹이기 위해서 Sonification은 하지 않는다.
- 시약은 차광병에 보관해야 하며 시약의 흡광도가 규정된 요구 조건에 적합하면 계속 사용할 수 있으나 1달 이상 사용하지 않기를 권장한다.
3.5.2.2 NEDD 용액
- N-(1-naphthyl) Ethylene Diamine Dihydrochloride (C12H14N2·2HCl) - 0.5 g
- 염산(HCl) - 5 mL
- 50% Triton X-100(5.1.3) - 1 mL
- 500 mL 부피플라스크에 초순수 약 300 mL를 넣고 미리무게를 재어둔 NEDD 0.5 g을 넣어 녹인다. 진한 염산 5 mL를 추가하여 잘 혼합한다. 시약이 완전히 녹으면 초순수를 첨가하여 부피플라스크의 500 mL 눈금까지 맞춘다. 50% Triton X-100 (5.1.3) 1 mL를 넣어서 잘 혼합한다.
- 시약은 차광병(amber)에 넣어서 보관해야 하며 시약의 흡광도가 규정된 요구조건에 적합하면 계속 사용할 수 있으나 최대 1달 이상 사용하지 않기를 권장함
3.5.2.3 Stock Imidazole buffer
- Imidazole(C3H4N2) - 6.81 g
- 염산(HCl) - 약 1.5 mL
- 미리 무게를 측정한 Imidazole 6.81 g을 1000 mL 부피플라스크에 넣고 초순수 약 800 mL로 용해시킨다. 초순수를 추가하여 정확히 1000 mL까지 맞춘 후 1000 mL 시약병에 옮겨 담는다. 센서를 보정한 pH측정기로 pH를 측정하면서 진한 염산(HCl)을 조금씩 추가하여 완충용액의 pH를 7.8로 맞춘다.
3.5.3 표준용액(Standard Solution)
3.5.3.1 Stock Nitrite Standard Solution(10,000 μM)
- Sodium Nitrite(NaNO2) 시약을 0.1725 g을 정량하여 도가니에 넣고 덮개를 덮은 다음 자연대류식 건조기에서 105~110℃로 2시간 정도 건조한다. 건조된 시약을 건조기에서 꺼내 진공 데시케이터에서 상온으로 방냉한다.
- 건조하여 상온으로 방냉한 Sodium Nitrite 시약 0.1725 g을 0.01 mg 분해능의 저울을 이용하여 0.001 g까지 정확하게 무게를 정량하고 측정된 시약의 무게를 0.00001 g까지 정확하게 기록한다. 무게 측정시의 실험실 습도와 온도를 측정하여 부력 보정된 정확한 질량을 계산하여 사용한다(부록에 첨부된 중력보정 방법 참고).
- 250 mL 플라스틱 부피플라스크를 저울에 올려놓고 영점조정을 하여 플라스크의 무게가 0이 되게 한다. 무게를 측정한 시약을 넣고 초순수 약 150 mL를 부피플라스크에 넣고 조심스럽게 완전히 녹인다. 이때 주의해야 할 것은 저울을 추가로 조작하지 않고 이전에 측정된 약 150 mL의 무게가 변하지 않게 하여야 한다. Sodium Nitrite를 완전히 녹인 다음 부피플라스크를 저울에 올려 초순수로 250 mL까지 정확하게 맞추고 저울의 눈금을 읽어 그 무게를 기록한다.
- 이때 사용되는 초순수의 온도와 실험실 습도를 측정하여 부피플라스크로 측정된 무게를 보정하여 부력이 보정된 정확한 무게를 계산한다. 보정된 무게, 온도 그리고 초순수의 밀도를 이용하여 정확한 부피를 계산하여 표준원액의 농도를 정확하게 계산한다.
3.5.3.2 Daily 검정곡선용 NO2 표준용액열(Calibation Standards) 제조
- Stock nitrite standard solution(5.3.1)을 이용하여 제조하는 검량선용 표준용액열 농도는 총 5개이며, 각각의 농도는 아래의 표와 같다.
- 가장 먼저, 농도가 제일 높은 표준용액 (Std.A, 5 μM)을 제조한다.
- 저울에 빈 500 mL 부피플라스크를 올려놓고 영점을 조정하여 무게를 0으로 맞춘다.
- 아질산이온 표준원액(5.3.1) 0.25 mL를 저울위에 있는 500 mL 부피플라스크에 옮긴 후 인공해수(5.1.2)를 첨가하여 500 mL로 맞춘다. 500 mL로 맞춘 표준용액의 무게를 측정하고 함께 습도와 온도로 중력보정을 실시하여 정확한 질량을 계산한다 (이때 농도단위는 μmol/kg이다). 이를 몰농도 (μmol/L, μM)로 전환하기 위해서 염분(35‰)과 실험실 온도로 검정곡선용 표준용액의 밀도를 계산하여 정확한 부피를 계산하여 몰농도로 전환한다.
- 다른 농도의 용액들도 위와 같은 방법으로 AACE Method에서 설정한 Calibrant 농도 값에 맞게 희석한다.
- 담수시료의 경우 인공해수 대신 초순수를 사용해 표준원액을 희석하여 위와 같이 제조한다.
3.6 시료의 전처리 및 보관
- 영양염 농도가 낮은 해수시료 채취는 가능한 깨끗한 환경에서 수행되어야 한다. 용존 영양염 분석을 위한 시료채취는 깨끗한 새용기 또는 10%염산으로 세척하여 초순수로 헹군 고밀도 폴리에틸렌(High Density Polyethylene, HDPE) 혹인 폴리프로필렌(Polypropylene, PP) 용기에 채취하여 수 시간 내 현장에서 분석하는 것을 권장한다. 자동영양염 분석기로 분석할 때는 폴리프로필렌 재질의 15 mL 튜브에 직접 채수하여 별도의 분취과정 없이 자동영양염 분석기의 Sampler rack에 직접 넣어 분석할 수 있다. 시료채취 시 시료 오염을 예방하기 위해 맨손으로 시료를 채취하는 것을 지양하고 분말가루가 없는 라텍스장갑의 사용을 권장하며 니트릴 또는 네오프렌 장갑의 사용은 권장하지 않는다.
- 나노몰 수준의 영양염 분석(특히 나노몰수준의 암모늄이온 분석)을 위한 시료는 용존산소와 미량기체 시료채취 직후에 시료를 채취하고 영양염 시료 채취 이전에 다른 시료를 채취하는 사람도 실험장갑을 사용해야한다. 시료는 니스킨병의 시료채취 꼭지로부터 직접 채취할 수 있으나 니스킨병 외부나 CTD 프레임에서 유입된 물로 인해 시료가 오염될 수 있다. 일관성을 유지하기 위해서 타이곤 튜브를 니스킨병 꼭지에 연결하여 시료를 채취할 것을 권장한다. 이 튜브는 시료 채취 직전에 시료로 충분히 헹군 다음 시료를 채취한다. 시료병 및 튜브는 시료해수로 세 번 헹군 다음 시료를 채취한다.
- 해수 중에 입자가 아주적은 빈영양 외해역에서 채취한 시료는 시료 처리 과정에서 발생할 수 있는 불필요한 오염을 최소화하기 위해서 여과할 필요가 없지만, 시료에 부유물질이 많은 경우에 시료를 0.2 μm PES(Polyethersulfone) membrane 여과지로 여과한 후 분석한다. 여과를 해야 하는 시료는 산 세척된 HDPE 혹은 PP 500 mL 용기에 시료를 충분히 채취하여 실험실로 운반한 후 0.2 μm 공경 PES 여과지로 여과한다. 여과 시 약 50 mL의 시료를 먼저 통과시켜 여과지를 씻고 여과된 해수를 이용하여 시료 보관 용기를 3번 세척한 후 시료를 채취한다.
- 시료 분석은 선상에서 바로 수행하는 것이 원칙이고 불가피한 경우 냉장 보관하고 늦어도 채수 후 8시간 이내에 분석하여야 한다. 현장 사정 등으로 8시간 이내에 분석할 수 없거나 장기간 보관해야 하는 경우는 시료 채취 후 바로 급속냉동(-80 ℃)해야 한다. 냉동 시 부피팽창을 고려하여 시료를 시료 튜브에 가득 채우지 않고 약간의 여유를 둔다. 시료를 냉동 또는 냉장 보관할 때 시료 용기를 반드시 수직으로 세워 누수를 방지한다. 냉동 보관기간은 짧을수록 좋으며 분석을 위해서 냉동시료를 해동하는 경우 분석하기 전 시료 병을 충분히 흔들어 시료를 잘 혼합한 후 분석한다.
3.7 검량선 작성
분석당일 시약 및 아질산이온(5.3.2) 표준용액열을 준비한다. 준비된 표준용액을 시료분석과 동일한 과정으로 분석한다. 다만 표준용액 제조에 사용된 바탕용액과 표준용액은 각 농도별로 2개 이상 복수로 분석되어야 한다. 측정된 자료를 선형회귀분석법으로 농도와 흡광도사이의 검량선식을 구한다. 표준용액열과 동일한 방법으로 분석한 시료의 흡광도를 검량선식에 대입하여 시료의 용존 아질산이온 농도를 구한다.
3.8 품질관리 및 품질평가(Quality Control and Quality Assessment, QA/QC)
3.8.1 정의 및 결정방법
품질관리 절차 및 자료의 품질평가는 측정의 정확도(Accuracy)와 정밀도(Precision)를 결정하는 수단을 제공한다. 분석자들이 품질관리(Quality Control, QC), 품질평가(Quality Assessment, QA), 정확도(Accuracy), 정밀도(Precision)사이의 차이를 이해하도록 정의를 하였다. 여기에 사용된 용어들의 정의는 Dickson(2007)의 “Guide to Best Practices for Ocean CO2 Measurement” 에 따른다.
3.8.1.1 품질관리(Quality Control)
측정 자료의 품질이 사용자의 필요에 부합하도록 관리할 목적으로 수행되는 전체 활동체계를 말한다. 품질관리의 목적은 생산된 자료가 일정한 확률에서 목표하는 정확도를 가지고, 만족할만하고, 신뢰할 수 있으며, 경제적인 품질을 제공하도록 하는 것이다.
3.8.1.2 품질평가(Quality Assessment)
품질평가가 효과적으로 수행되도록 보장할 목적으로 수행되는 전체 활동체계를 말한다. 품질평가는 분석과 분석체계 성능의 품질에 대한 지속적인 평가를 제공한다.
3.8.1.3 정확도(Accuracy)
정확도는 측정값이 참값에 일치하는 정도를 반영하는 편이(Bias)와 정밀도(Precision)의 결합이다. 정확도는 측정값과 표준물질의 명시된 특성값과 일치하는 정도이다. 정확한 방법은 편이가 없는 결과를 제공한다. 정확도는 평가하기 몹시 어려운 정량평가이지만 계통오차를 일으키는 원인을 찾는데 활용한다.
정확도 = [측정값 - 표준물질특성값/측정평균] × 100
3.8.1.4 정밀도(Precision)
동일한 시료에서 분석하고자 하는 항목을 연속적으로 반복 실험할 때 발생하는 무작위오차(random error)를 의미하고, 특정한 실험과정의 재현성을 측정하는 항목이다. 최종결과 또는 시료채취에서 전처리 등을 포함하는 전체과정 또는 특정한 단계에 적용할 수 있다. 동일한 시료에 대한 반복측정 값의 평균과 표준편차로 평가한다. 동일한 시료의 반복 분석할 때 분석값들의 상호간에 가까운 정도를 설명하는 것으로 때로는 재현성으로 불리기도 한다. 정밀도는 절대표준편차(absolute standard deviation), 상대표준오차 (relative standard deviation, RSD), 분산(variance), 변동계수 (coefficient of variation, CV), 상대백분율차이(relative percent difference), 측정의 절대범위(absolute range of a series of measurement) 등으로 표시된다. RSD는 일반적으로 농도가 낮을수록 커지는 경향이 있다.
% RSD = [표준편차(s)/측정평균] × 100
3.8.1.5 방법검출한계(Method Detection Limit, MDL)
방법검출한계는 일정 농도의 시료를 반복 분석하여 특정 신뢰도 수준에서 바탕값과 다른가를 통계적으로 판단한 값으로 측정할 수 있는 분석성분의 최소한의 농도값이다. 이는 매질, 분석기기, 분석자에 따라 차이가 나기 때문에 잘 확립된 분석방법으로 숙련된 인력으로 결정한다. 방법검출한계는 같은 분석법을 사용하고 있는 다른 실험실들 사이의 분석능력을 비교하거나 같은 실험실에서 다른 분석방법간의 차이, 또는 분석 인력간의 차이를 비교하는 좋은 방법이다. 미국 EPA에서는 방법검출한계를 99%의 신뢰도에서 분석성분 농도가 0보다 클 경우 이를 성분의 최소 측정 농도로 정의한다. 통계학적으로 99%신뢰도 구간이 의미하는 것은 방법검출한계와 같은 농도로 분석하는 성분이 검출된 것은 이 성분의 농도가 0보다 높게 존재할 가능성이 99%라는 것을 의미한다. 다른 말로는 1%는 분석하는 성분 농도가 0이지만 실제 존재하고 있는 것으로 거짓으로 측정된 것을 의미한다. 방법검출한계는 통계적인 개념으로 분석성분이 방법검출한계보다 낮은 농도로 측정될 가능성이 충분히 있다(기기검출한계와는 구별되어야 함). 방법검출한계는 분석의 불확도를 다루는 절차일 뿐이고 시료의 채취, 운반, 보관, 분석의 전 과정에서 불확도의 요소가 있다. 저농도 반복시료를 분석하여 방법검출한계를 계산하는 것은 많은 시간이 걸리고, 대부분의 실험실에서는 보고하기에 적당한 수를 얻기에 필요한 수십 번의 연구를 반복할 여유가 없다. 따라서 방법검출한계 측정을 무효화 할 수 있는 검정곡선 범위, 첨가정도, 바탕값의 오염 등과 같은 것을 잘 조절하는 것이 중요하다. 실험실에서는 최종적인 방법검출한계 계산 값에 도달하는 정확한 과정에 대해서 기록해야 하며, 방법검출한계는 분석값의 품질을 확인할 수 있는 중요한 자료이기 때문에 추적할 수 있어야 한다. 방법검출한계 측정방법은 8.6항의 순서를 따른다.
3.8.2 품질관리 및 품질평가 수행 표준절차 (Standard Operating Procedures, SOP)
품질관리는 기기를 설치하는 것으로 시작하여, 분석관 구성 및 유지 보수와 같은 세심한 부분까지 포함한다. 일단 기기가 설치되면 표준운영절차를 확립하여 시료를 분석하여야한다. 다음의 사항들은 필수적으로 표준운영절차에 포함해야 한다.
- 유리기구와 피펫의 교정
- 표준용액열과 검량선식
- 시스템의 일일점검사항 실시, 공기방울 형태의 점검, 시약을 분석관에 연결하기 전후의 기저선 변화의 지속적인 추적
- 같은 설정과 민감도로 시험시료(주로 가장 높은 농도의 표준용액)를 분석하여 기기의 작동상태 확인
특히 시약을 새롭게 바꾸거나 분석관의 튜브를 교체한 후 분석기의 민감도(gain)를 동일하게 설정하여 동일한 시험시료를 측정하는 것은 넓은 의미에서 좋은 품질관리 방법이다. 만약 이전의 측정값과 다르게 나온다면, 시약을 새롭게 만들거나 튜브를 교체한 후 분석기기에 변화가 있고 점검이 필요함을 조기에 파악할 수 있는 방법이다. Seal사의 분석 프로그램 AACE에서는 표준철차 수행에 도움을 주는 기능이 포함되어있다. Water check, Reagent check 기능으로 분석 전 장비의 기저선, 기체분절 간격, detector energy를 분석 전 점검하여 기기의 상태를 일관성있게 관리할 수 있다. 또한 표준용액열 및 검량선 설정하여 분석 중 계산된 농도값을 확인가능하며 Drift correction, Baseline correction, Recovery detection 등의 기능으로 교정된 값을 얻을 수 있다.
3.8.3 내부확인 (Internal Checks)
시료분석 동안의 자료품질 보증을 위해 내부확인이 반드시 사용되어야 한다. 내부확인에 사용되는 방법으로는 시료분석을 위해 기기를 작동할 때 마다 시료중복 분석, 확인시료 분석, 내부표준물질 분석을 실시하여야 한다.
시료중복 분석은 동일한 시료를 서로 상이한 분석에서 반복 측정하는 것으로 시료 중복분석 표준편차로 분석간의 자료품질을 더 정확하게 판단할 수 있다. 확인시료 또는 추적표준물질을 사용하여 분석간의 편차를 줄일 수 있으며 확인시료 또는 추적표준물질 값을 이용하여 분석자료를 조정한다.
확인(추적)시료는 관측초기에 심층해수(~1000미터 수심)를 채취해서 사용할 수 있다. 심층해수는 대부분의 영양염 (암모늄과 아질산이온 제외) 농도가 높으나, 검량선 범위를 벗어나지 않아야 한다. 채취된 심층해수를 포화 염화수은을 시료 10L에 1 mL에 해당하는 양을 첨가하여 보존한다. 앞서 시료를 보존할 때 카드뮴환원관의 환원효율에 영향을 미치기 때문에 독성물질을 사용하지 않기를 권장하였으나 시료분석 시 1개의 염화수은을 첨가한 시료를 분석하는 것은 카드뮴 환원 관의 환원 효율에 영향을 미치지 않는다. 확인(추적)시료의 분석값을 지속적으로 추적하는 것은 분석자에게 분석기의 성능이나 시약과 관련된 문제들에 대해 경각심을 주는데 도움이 된다. 자료보고서에 각 분석채널에서 확인(추적)시료의 분석값과 표준편차를 보여주는 표를 첨부하여 분석결과가 신뢰할 수 있음을 보여 주어야 한다. 앞서 언급하였듯이 확인(추적)시료의 분석값이 원하는 정밀도 범위 내(평균값의 1%이내)에 있다면 이 값을 이용하여 분석자료의 값을 조정할 수 있다.
Van Ooijen and Bakker(1992)는 초순수에서 충분한 양의 혼합 농축 표준용액을 준비하여 포화 염화수은 첨가하여 보존한 내부표준물질 사용에 대해서 설명하였다. 이러한 내부표준물질은 분석에서 검량선 작성에 사용하는 일차 또는 작업용 표준용액열을 만드는 것과 독립적으로 준비해야 한다. 내부표준용액을 저영양염 해수로 적절히 희석하여 CFA분석기를 사용하여 분석할 때마다 사용한다. 이러한 추적용액은 한 번의 희석으로 만들어져 있어 재현성은 0.1%이고 이는 피펫에 내재된 오차 때문이다. 이러한 추적용액은 현장에서 사용되는 시료와 같은 범위의 값이고, 전체 검량선 범위의 60~80% 정도 내에 있을 때만 사용이 허용된다. 추적용액은 저영양염 해수로 희석하고 각 분석에서 시료와 시료사이에 측정하고 각 분석에서 여러 번 분석한다. 각 실험실은 일정기간 동안(1개월 정도동안 최소 10회 정도) 분석한 추적용액 또는 확인시료의 평균값을 계산하여 시료 분석값을 추후 조정한다.
3.8.4 외부 품질확인(External Quality Checks)
외부품질확인은 상이한 항해와 실험실간 분석자료의 상호비교를 평가하는데 사용한다. 국내 또는 국제적인 상호비교실험 등은 외부품질확인의 예이다. 또 다른 형태의 외부품질확인은 시료분석 시 인증표준물질(Certified Reference Materials, CRM), 표준물질 (Reference Materials, RM) 등을 동시에 분석한다. 이렇게 사용되는 인증표준물질과 표준물질은 보존처리가 이루어지고 영양염 농도를 잘 결정된 실제 해수 시료이다. 인증표준물질과 표준물질은 항차 내(정점 간, 새로운 시약이나 표준용액열을 만든 후), 다른 항차 간, 또는 다른 실험실에 의해서 수행된 분석 결과의 일관성을 보장하기 위해서 사용된다. 인증표준물질은 다양한 농도로 구성되고 다양한 해양조건과 염분을 대표할 수 있는 염분값을 가지고 있다. 모든 영양염 분석에서는 인증표준물질을 사용하도록 강력하게 권장하고 있으며, 특히 국제적인 프로그램(GO-SHIP,CLIVAR, GEOTRACES)과 같이 정확도가 아주 높은 자료를 생산하는 항차 또는 실험실은 영양염 인증표준물질의 사용이 필수적이다.
3.8.4.1 인증표준물질
최근 일본 KANSO Technos사에서 해수 영양염 표준물질(RMNS)을 개발하여 생산하고 있는 것이 국제적으로 많이 사용되고 있으며 SCOR Nutrient WG147은 JAMSTEC과 협조하여 총 5세트 (태평양 2세트와 대서양 3세트)의 영양염 표준물질을 생산하여 보급하고 있다. 이 표준물질은 100 mL 플라스틱 용기에 담겨 있다. 한국해양과학기술원과 Eurofins등도 해수 영양염 표준물질을 생산하고 있다. 분석 시 깨끗한 시료 튜브에 옮겨 담아 매 분석 시 최소 하루에 1회 이상 시료와 함께 분석되어야 한다. SCOR-JAMSTEC과 KANSO 인증표준물질은 별도의 검정절차를 통하여 국제도량체계(SI)에 연결되어 있다. 질산이온, 아질산이온, 인산이온 검량선은 Chemicals Evaluation and Research Institute(CERI)의 Japan Calibration Service System(JCSS), National Metrology Institute of Japan(NMIJ)등의 표준용액을 사용하였으며 표준용액의 불확도가 포함되어 있다. 용존실리카 검량선은 Merck KGaA에서 생산한 표준용액과 National Institute of Standards and Technology(NIST) 표준용액(SRM3150)을 사용하였으며 각각의 불확도를 가지고 있다. 인증표준물질을 사용하여 GO-SHIP에서 기술된 영양염 분석방법으로 기기의 검량선을 작성하였으므로 영양염 분석결과의 상호비교가 가능하고 명확히 SI에 연결되어 있다.
3.8.4.2 인증표준물질/표준물질 사용
각 분석 시 앞서 언급된 내부확인 시료와 추적시료를 시료와 함께 분석되어야 하며 최소 하루에 한 번은 분석되어야 한다. 이론적으로는 매번 새로운 인증표준물질을 열어 사용할 것을 권장한다. 그러나 실제 대부분의 실험실에서는 비용적으로 부담을 많이 느낀다. Scripps Institute of Oceanography와 Royal Netherlands Institute for Sea Research의 실험실은 표준물질병을 열고 최대 2일까지 사용하는 경우도 있으나 한번 사용한 표준물질을 당일 이후에 사용할 때에 오염되지 않도록 주의하여야 한다. 일부 실험실에서 농도가 다른 여러 개의 표준물질로 검량선을 작성하려는 시도가 있다. 그러나 농도가 다른 여러 종류의 표준물질을 구비하는 것은 비용적으로 상당한 부담이 될 수 있다. 매월 각 채널에서 시료와 함께 분석된 인증표준물질과 표준물질의 참값(특성값) 및 분석평균값과 표준편차를 포함하는 표를 자료보고서에 포함하여야 한다. 이상적으로는 인증표준물질과 표준물질의 분석값은 참값(특성값)과 같아 자료의 추가적인 보정이 없어야 한다. 만약 인증표준물질과 표준물질의 분석값이 참값(특성값)과 다르면, 다른 것을 표시하여 주의를 할 수 있도록 해야 한다. 아직 인증표준물질과 표준물질을 이용하여 자료를 조정 또는 수정하는 것에 대한 이견이 있다. 만약 인증표준물질과 표준물질을 미지의 시료로 분석하였다면, 시료의 분석값을 인증표준물질 또는 표준물질의 분석값(특성값)을 이용하여 보정할 것을 권장한다. 실제 시료분석을 담당하는 분석자가 분석 시 기기상태를 잘 알고 있기 때문에, 인증표준물질과 표준물질 분석값을 이용하여 시료의 분석값을 조정 또는 수정을 직접 하는 것이 바람직하다. 조정 내용을 문서화할 때 조정/수정된 값을 인정표준물질의 참값(특성값) 및 분석값(평균과 표준편차)과 함께 보고하여야 한다.
3.8.5 자료비교
먼저 초기 확인과 수정을 수행한 후, 일차 또는 이차 품질관리(Quality Control, QC) 점검들이 수행되어야 한다. 일차 품질관리는 특이값 및 명백한 오류를 식별하기 위해 자료를 연구하는 과정입니다. 이러한 특이값은 별도로 표시하거나, 수정 가능한 오류를 식별할 수 있는 경우 자료를 수정한다. 이차 품질관리는 보고된 값의 계통 편향을 정량화하기 위해 자료를 객관적으로 연구하는 과정이다.
일차 품질관리로 시료채취병(니스킨 등)의 시료채취 수심이 잘못되었거나, 시료채취병 이상으로 인한 누수, 시료채취 및 분석 시 오염 등의 문제로 인해 발생할 수 있는 오차 등을 확인한다. 다음에 분석된 시료값과 시료를 채수한 수심의 다른 물리/화학적 자료로 함께 그림을 그려 비교한다. 예를 들어 영양염 자료를 염분, 수온, 용존산소, 용존 무기탄소과 함께 그림을 그려 분포특성 또는 특이값이 다른 자료에서도 나타나는가를 확인한다. 질산이온+아질산이온(암모늄이온이 분석되었다면 포함하여) 대 인산이온 그림, 용존실리카 대 용존산소 그림을 통해 어떤 값이 문제가 있는지 확인한다. 이러한 그림은 각 정점에서 영양염과 함께 다른 자료가 모두 분석하여 각 정점별로 수행할 것을 권장한다. 연속되는 정점의 값들을 자세히 살펴보고 값의 변이가 진짜인지 아니면 감도, 분석 또는 오염의 문제는 아닌지 확인해야한다.
이차 품질관리는 역사적인 자료를 이용하여 계통 편향을 감지하기 위해서 사용될 수 있다. 전 대양에 있는 GO-SHIP (이전 CLIVAR)과 WOCE 단면도 자료를 공공자료로 CCHDO(cchdo.ucsd.edu)와 같은 자료실을 통해 접근할 수 있다. GLODAP에 있는 편향이 조정된 자료를 사용할 것을 권장한다. 분석 중에 잠재적인 편향을 발견하게 되면 분석 절차상 편향을 낼 수 있는 가능한 요소를 찾아낸다. 그리고 편향 수정을 하지 않고 메타데이터에 편향 문제에 반드시 기록하여야 한다.
3.8.6 방법검출한계 측정방법
3.8.6.1 분석시스템 준비
방법검출한계 시료는 방법 선택에 명시되어 있는 필수 품질관리 확인 사항을 통과하고 동작이 적절한 기계를 사용해서 분석한다. 분석시스템의 청결이 방법검출한계 계산에 영향을 미친다. 따라서 이미 사용하고 있던 분석기의 방법검출한계를 측정할 때는 이전 시료로부터 발생하는 오염을 피하기 위한 사전예방 조처를 해야 한다. 대부분의 실험실에서는 정기적으로 분석기 유지보수를 수행하여 분석기가 아주 깨끗하고 적절히 반응하도록 해야 한다.
3.8.6.2 방법검출한계 수행을 위한 검정
적절한 교정은 유효한 방법검출한계 결정을 위한 핵심 요소이지만 종종 그 중요성이 간과된다. 분석법에서 올바른 검증은 분석될 시료의 예상 농도값을 포함해야 한다. 방법검출한계는 시료 분석에 사용되는 검정곡선과 같은 식으로 계산되어야 한다. 일반적으로 가장 낮은 검정곡선용 표준용액 농도는 정량한계(또는 예상되는 정량한계)와 대략 비슷해야 한다. 아주 높은 농도를 분석할 때는 낮은 방법검출한계 달성이 쉽지 않다. 실험실에서 정량한계보다 낮은 시료분석이 빈번히 수행되지 않는다면 많이 요구되는 방법검출한계 달성이 불가능하다. 일반적으로 분석기기 제조사에서 기기의 정량한계를 명시하는데, 통계결정에 필요한 충분한 자료가 없다면 이 값을 실험실의 정량한계로 간주할 수 있다.
3.8.6.3 적절한 첨가 정도의 선택
방법검출한계는 동일한 조건에서 7번 이상의 반복측정의 정밀도 또는 변동성에 기반하고 있다. 정밀도는 시료결과의 표준편차를 이용하여 계산되기 때문에 농도에 의존하기 때문에 방법검출한계 실험에 사용되는 시료의 농도 선택이 아주 중요하다. 방법검출한계는 검정곡선의 가장 낮은 농도수준 추정에 사용되기 때문에 최상의 첨가 수준은 예상되는 검출 수준의 1~5배 정도이다. 정밀도는 농도에 의존하기 때문에 계산된 방법검출한계는 첨가 수준의 10분의 1보다 커야한다. 이 값이 방법검출한계 연구를 위한 최대값이고, 이 값보다 낮은 농도를 첨가하는 것이 바람직하다. 계산된 방법검출한계는 방법검출한계 측정을 위해 첨가한 수준보다 높지 않아야 한다. 논리적으로 계산된 방법검출한계가 첨가 수준보다 높다면 통계학적으로 첨가시료와 바탕값을 구별할 수 없다. 그리고 정밀도가 아주 나쁘다. 다음의 부등식이 계산된 방법검출한계를 평가하기에 유용하다.
3.8.6.5 반복시료 준비
최소 7개의 반복시료를 준비한다. 그러나 혹시 이상값이 발생하여 제거하는 것을 고려해서 8개 시료를 준비할 것을 권장한다. 반복시료들은 분석 방법에 설명되어있는 시료 준비와 같은 방법으로 준비 및 처리(예를 들어 추출, 대용물 추가, 분해 등) 되어야 한다. 시료와 같이 처리되지 않은 반복시료로부터 계산된 방법검출한계는 받아들일 수 없고 진정한 방법검출한계를 대표할 수 없다. 대부분의 환경 분석에서는 초순수에 분석대상 성분을 위에서 설명한 적당량을 첨가하여 방법검출한계를 측정하는데 필요한 최소 7번 이상의 반복측정을 할 수 있도록 반복측정 시료원액 1개를 준비한다. 그러나 일부 휘발성 유기성분 또는 대용량 추출시료 분석에는 한 개의 시료로 여러 번 반복측정 하는 방법은 적합하지 않고 개별포장의 반복시료를 만들어 측정해야 한다. 또한 해수 시료의 경우 매질 효과로 인한 오차를 최소화하기 위해 해수 매질(저영양염 해수, 인공해수) 기반에 분석성분을 첨가하고 최소 7번 이상의 반복분석을 할 수 있는 양을 제조해야 한다.
3.8.6.6 바탕값 측정
배경 오염을 측정하기 위해서 최소 1개의 방법 바탕값이 각각의 방법검출한계 시료세트와 함께 분석되어야 하고 실험실 인정을 위해서는 바탕값 측정결과를 보고해야 한다. 바탕값은 계산된 방법검출한계의 유효여부를 알 수 있는 중요한 품질관리 수단이다. 실험방법이 시료 결과로부터 바탕값을 빼야하는 경우, 각각의 시료에 대해서 쌍으로 방법 바탕을 분석해야 하고 절차에 명시된 것처럼 시료로부터 바탕값 평균을 뺀다.
3.8.6.7 일일변동
실제 분석에서는 방법검출한계 값이 분석 때 마다 변한다. 이러한 변동성을 고려하여 실제 방법검출한계를 계산하기 위해서는 다른 batches에서 7개 이상의 반복시료를 준비하여 분석하거나, 다른 날에 분석한 방법검출한계 값을 모아 사용한다. 또 다른 방법은 장기간의 변화를 고려하기 위해서 일정기간 이상 측정된 방법검출한계 자료를 모아서 표준통계절차를 사용하여 실험실의 일상적인 방법검출한계로 한다.
3.8.6.8 바탕검출한계 계산
바탕검출한계를 계산할 때 주의사항은
(1) 시료 표준편차(s) 사용
(2) 올바른 Students t-value 사용
(3) 모든 유효숫자사용
바탕검출한계 계산에서 흔히 하는 실수는 시료표준편차(s) 대신 모집단 표준편차(σ)를 사용하는 것이다.
Sample standard deviation (s):
\[
s=\sqrt{\frac {\Sigma {(x- \bar x)}^{2}} {n-1}}
\]
\(\bar x\): sample mean; n-1: degree of freedom;
Population standard deviation (σ): \[ \sigma=\sqrt{\frac {\Sigma {(x- \mu)}^{2}} {n}} \] \(\mu\): population mean; n: number of population
방법검출한계 \(={t_{(n-1, ~1-\infty=0.99)}\times s}\)
\(t_{(n-1, ~1-\infty=0.99)}\): 99%신뢰도 수준과 자유도 n-1에서 추정된 표준편차에 대한 students’ t value
\(s\) : 반복분석의 표준편차
앞에서 계산한 방법검출한계를 위한 95% 신뢰도 구간 추정은 자유도 분포 분의 chi 제곱(X2/df)의 백분위 수로부터 유도된 다음식에 따라 계산된다.
여기서 LCL과 UCL은 7번의 측정값에 기초한 95% 신뢰도 구간의 낮은 쪽과 높은 쪽의 값이다.
모집단 표준편차는 참모집단 자료가 존재할 때만 사용하는 것이다. 그러나 대부분의 실험실에서는 모집단을 가정할 수 있는 정도의 충분한 반복자료가 없기 때문에 항상 시료 표준편차를 사용한다. 대부분의 프로그램은 둘 다 수행이 가능하기 때문에 올바른 것을 사용해야 한다. 계산과정에서는 모든 유효숫자를 사용하고 방법에 관한 결과 보고 시 마지막 바탕 검출한계 값의 유효숫자를 정한다. 예를 들어 계산된 바탕검출한계 값이 0.15이면 유효숫자가 하나일 경우 0.2로 반올림한다.
3.8.6.9 S/N시험
바탕검출한계 과정에서 검출한계는 신호/잡음의 비가 2.5-5일 때 추정된다. S/N비는 초기 검출한계 추정과 최종 바탕검출한계 결정을 평가하는데 유용하다. 신호/잡음비가 2.5보다 작은 것은 연속 반복측정의 임의 오차가 아주 높아 측정된 바탕검출한계가 높다는 것이다. 이는 반복시료에 첨가를 더 많이 하여 신호를 높여야 한다. 만약 신호/잡음의 비가 10보다 커다면 첨가 농도가 너무 높아 계산된 바탕검출한계가 실제 검출한계를 대표할 수 없다. 이 경우에 첨가를 적게 하여야 한다. 신호/잡음의 비가 10이상이더라도 분석방법이 아주 정확할 수도 있다. 이 경우에는 분석자의 경험이 아주 중요하다.
(S/N)est = Xave/s
Xave: 계산된 농도나 반복측정의 분석 신호의 평균
s: 반복 측정되는 시료 표준편차
3.8.6.10 바탕검출한계 결정주기
바탕검출한계가 여러 가지 이유로 시간에 따라 변하기 때문에 필요하면 주기적으로 바탕검출한계 계산을 수행한다(새로운 분석법을 사용하기 전 또는 1년 주기로 갱신함). 만약 방법에 특정한 주기를 명시되어 있지 않으면 새로운 분석자가 분석을 시작하거나 분석시스템의 성능이 변하거나 하면 방법검출한계 시험을 시행한다. 그리고 분석과정이 변경될 때마다 재계산해야 한다. 일부 시험실에서는 1년 단위로 방법검출한계의 유효기간을 정하여 항상 사용이 가능한 방법검출한계 값을 유지한다. 계산된 방법검출한계 값을 보고하기 전에 아래 5가지 확인 사항을 충족하는지 점검하여야 한다.
(1) 첨가 수준이 방법검출한계 값의 10배를 초과하는가? 그렇다면 첨가 수준이 너무 높다.
(2) 방법검출한계 값이 첨가 수준보다 높은가? 만약 그렇다면 첨가수준이 너무 낮다.
(3) 계산된 방법검출한계 값이 과제에서 요구되는 규정 요구사항을 충족하는가?
(4) Signal/Noise (S/N)비가 적정한 범위에 있는가?
(5) 반복시료의 회수율은 적당한가? 3.8.7 문서화
3.8.7.1 관측보고서
관측보고서에는 다음과 같은 사항이 포함되어야 한다.
- 항차 명칭과 연구 책임자
- 시료 분석자의 이름과 소속
- 총 분석시료 수, 사용한 표준물질 종류, 분석기 튜브 및 카드뮴 교체횟수, 기타 필요한 통계
- 사용한 분석기기, 분석방법, 시약
- 시료채취방법 및 저장방법
- 검량선용 표준용액 정보, 방법, 그리고 농도
- 자료획득 및 처리 절차들
- 유리초자 및 피펫 교정
- 분석 중 발생한 문제와 이를 해결하기 위한 방법 등에 대한 자세한 서술
- 품질관리/품질보증
- 정해진 정확도와 정밀도
- 최소 검출한계
- 확인(추적)시료 분석값
- 인증표준물질 또는 표준물질 분석값(사용한 표준물질 또는 인증표준물질 종류와 특성값을 함께 기록)
- 확인(추적)시료 또는 인정표준물질, 표준물질을 이용하여 분석값을 조정 또는 수정하였으면 조정 또는 수정 방법에 대해 자세히 기술
- 참고문헌
3.9 기체분절 영양염 자동분석기를 사용한 해수 중 용존 영양염 분석절차
3.9.1 분석 사전준비
3.9.1.1 영양염 자동분석기기 준비
1.1.1.1. 용존 영양염 분석에 사용되는 QuAAtro console, sampler, 외부 detector, 컴퓨터 전원을 켠다.
1.1.1.2. Sample Wash solution을 준비한다.
(1) 기기를 처음 작동하였을 때는 초순수를 sample wash solution으로 사용하고 시료분석이 시작되면 인공해수나 저영양염 해수를 sample wash solution으로 사용한다. 따라서 초순수와 인공해수 또는 저영양염 자연해수를 wash solution으로 사용한다. 따라서 두 개의 wash solution bottle과 각각의 용액을 준비한다.
(2) 분석도중 Wash solution을 추가 할 경우 baseline의 상승 또는 하강하는 현상이 나타날 수 있기 때문에 매일 분석에 소비되는 양을 계산하여 Sample Wash solution을 만들어 사용하고 분석도중 sample wash solution을 교체하지 않도록 한다 (분석시간 * wash solution flow rate).
1.1.1.3. 시약튜브를 미리 준비한 system wash solution(N계열: wash triton-X, Phosphate와 Silicate: wash SDS)에 넣는다.
1.1.1.4. 각각의 분석채널에 연결되어 있는 각 종 시약 및 시료 튜브의 상태를 눈으로 점검하여 튜브가 찢어진 곳이 있는지 점검한다. 이상이 있을 시에는 튜브를 교체한다.
1.1.1.5. 펌프 덮개를 닫아준다 (부록 장비 구성 참조)
3.9.1.2 컴퓨터에서 분석프로그램 (AACE)의 준비
1.1.1.1. AACE 프로그램을 실행한다.

1.1.1.1. AACE 프로그램을 실행하면 아래와 같은 화면이 나타난다.
1.1.1.1. 시스템창의 charting 버튼을 클릭하면 5항목(NO2-N, NO2+NO3-N, NH4-N, SiO2-Si, PO4-P)의 분석창이 뜨면서 장비가 작동하게 된다.
1.1.1.1. 각 창에 마우스 커서를 두고 우클릭하여 smoothing을 0으로 설정하고 암모늄이온 분석창은 smoothing을 8로 설정한다. 피크 정상부분이 평평하지 않으면 smoothing값을 높여 피크정상부분을 평형하게 하려는 시도가 종종 있으나 이는 권장하지 않는다. Smoothing 값을 크게 하면 분석 시 피크가 완만하게 상승하고 피크 정상 부분의 평평한 상태로 유지되는 시간이 짧아 피크가 뾰족한 모양으로 나와 안정된 분석값을 얻기 어렵다.
3.9.1.3 기기세척 및 안정화
펌프의 시약튜브를 System Wash solution(5.1.4)에 담가 sampler의 sample wash solution에 증류수를 연결하여 펌프를 작동시키면서 분석기기가 안정될 때까지 기다린다. 안정화는 흡광도가 baseline 값인 5%에서 ±0.1% 범위내로 일정하게 유지되는 상태이다. 기기를 켠 후 약 1시간이 소요된다. baseline 값이 5%에서 ±0.1% 이상 벗어나게 되면 아래 9.2.2.1의 내용처럼 set base를 실시하여 baseline을 조정한다.
3.9.1.4 시약 제조
1.1.1.1. 냉장고에서 standard stock(5.4.1)을 꺼내서 실온으로 맞춘다. 온도차이로 인해 피펫팅 시 부피가 변하지 않도록 일정한 온도를 유지하도록 노력한다. 1.1.1.2. 발색 시약제조법(5.2)을 참고하여 분석 전 혹은 분석 당일 발색시약을 제조하고, 5.3을 참고하여 5개 이상 농도구간의 용존 아질산이온 표준용액을 만든다.
3.9.1.5 시료의 준비
1.1.1.1. 냉동시료는 해동하는 데 시간이 많이 소요되므로 해동하는 시점을 잘 정해야 한다. 분석기기가 준비되기 전에 미리 시료를 해동했는데 분석기기에 문제가 생기면 분석을 할 수 없어 해동한 시료의 처리가 곤란하므로 적절한 시점에 녹여야 한다. 약 10 mL 시료의 경우 미온수에 1시간 이상 해동이 필요하고 50 mL 이상 용량의 시료는 2~3시간 이상 해동이 필요하다. 해동된 시료는 분석 전 상온에 보관하여 실온에 맞춘다.
1.1.1.2. 용존실리카의 경우 특수한 경우를 제외하면 24시간 이상 해동이 필요하므로 해동 한 다음 날 추가분석이 필요하다. 아래는 24시간 이상 해동이 필요하지 않은 시료의 조건이다(아래의 조건을 모두 충족해야한다).
- 용량 15 mL 이하
- 채수 직후 –80 ℃ 초저온 냉동 보관
- 보관 기간 한 달 이내
3.9.2 분석준비
3.9.2.1 QuAAtro 분석프로그램 (AACE) 분석파일 작성
1.1.1.1. Set up - Analysis - New analysis에서 새로운 Analysis file을 생성한다(아래 그림 참조).
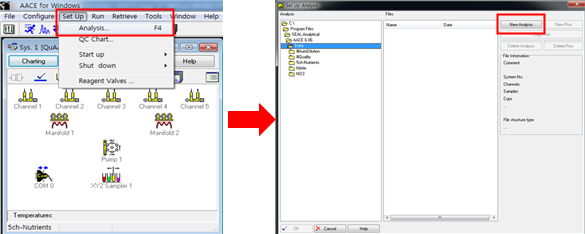
1.1.1.1. 위에서 New analysis 항목을 선택하게 되면 아래와 같이 Set Up: Analysis-new****.anl 창이 나타난다. 이 창에는 Main Page, Tray Protocol, Channel 1~5 탭들을 확인할 수 있다.
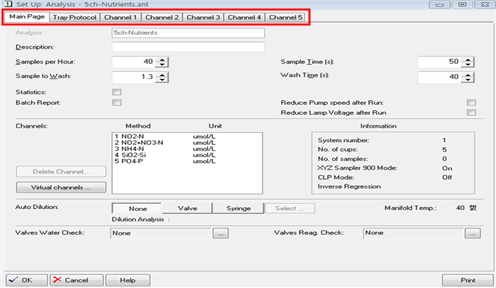
1.1.1.1. Main Page : 각 채널들에 공통적으로 적용되는 항목을 설정하며 분석명과 Sample/Wash time을 설정할 수 있다. 한국해양과학기술원에서는 Sample/Wash time을 45초/15초로 설정하여 사용하고 있다. 이 시간을 변경하게 되면 peak 정상부분이 변형되는 ISAC현상이 나타날 수 있으니 변경 시에는 충분한 검토가 필요하다. Peak 정상부분에 ISAC현상이 일어날 경우에 대한 조치는 제조사에서 제공한 매뉴얼(부록4)을 참고하여 조치를 해야한다. 1.1.1.1. Tray Protocol : 분석 시 필요한 시료 목록을 작성한다.
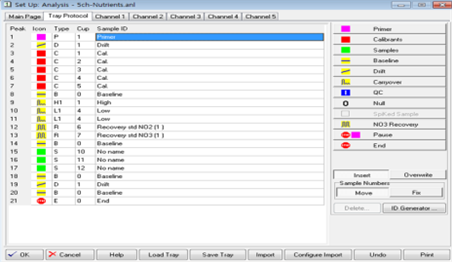
primer: 분석기기의 시작을 위해 맨 처음 분석되는 시료로 분석기기의 운용 프로그램에서 primer를 peak로 인식해야만 그 후 분석하는 시료의 peak와 tray protocol에 입력한 분석 순서를 일치시킬 수 있다. primer의 peak 높이는 약 30%로 설정되어 있으며(분석기기 매뉴얼 권장 사항) 5가지 영양염 항목들이 모두 포함되어있어야 한다. primer의 피크 높이는 main page에서 수정 가능하다.
calibrants: 농도계산에 사용될 검정곡선을 위한 표준용액열이다. 표준용액열의 최대 농도는 예상되는 시료의 최대 농도보다 높은 농도로 준비한다. Channel 탭(9.2.1.5)에 표준용액열의 농도를 입력하고 검량선 종류를 선택하면 프로그램에서 환산한 농도를 분석창에서 확인할 수 있다.
drift: 분석 중 발색시약의 변화와 같은 분석 조건의 변화에 의한 시료 농도값 변화에 영향을 주는 것을 보정하기 위한 시료이다.
carry over: 앞에 분석된 고농도 또는 저농도 시료가 다음 시료에 미치는 영향을 보정하기 위한 것으로 high-low-low순서 또는 low-low-high 순으로 표준용액열의 가장 높은 농도와 가장 낮은 농도(’0’값 제외)를 차례로 분석하게 하면 프로그램에서 자동적으로 보정할 수 있다. 이 순서는 검정곡선에 사용되는 표준용액열과 시료를 분석할 때 고농도에서 저농도 (high-low-low) 또는 저농도에서 고농도 (low-low-high)로 분석하느냐에 따라 다르게 사용된다.
baseline: 미량의 영양염 분석을 위해 초순수를 baseline용액으로 이용한다. 초순수를 세 번 반복 분석하여 마지막 peak를 baseline으로 설정한다. 표준용액열 전 후, 인증 표준물질 전 후, 시료 약 20개 분석 전 후로 초순수를 분석하여 baseline을 주기적으로 분석한다. 또한 고농도 시료 분석 후 저농도 시료 분석 시 잔류영향(Carryover effect)를 제거하기 위해 초순수를 분석한다.
Sample: 시료분석 순서는 저농도에서 고농도로 시료를 배치하고 정점과 정점 사이에 증류수를 분석하여 정점을 구분한다. 정점 당 시료의 개수가 12개 미만이면 두 개 정점을 분석한 후에 drift를 넣어 이를 보정할 수도 있다. 분석할 시료수가 많으면, 검량선의 유효성을 확인하기 위해서 시료 20-24개마다 baseline(증류수)과 drift (primer)를 분석한다. Drifter의 평균회수율이 80~120%이면 시험에 사용된 검정곡선을 유효한 것으로 보며 그 변화된 값을 보정해준다 (drift correction). drift 시료는 두 번 이상 분석하여 마지막 결과를 사용하여 보정에 이용한다.
MDL시료: 제조사의 검출한계나 예상 검출한계의 5배의 농도로 결정된 시료(용존 아질산이온 약 0.1 μM, 용존 질산이온 약 1 μM, 용존 암모늄이온 0.2 μM, 용존실리카 3.5 μM, 용존 인산이온 0.1 μM). 방법검출한계 측정용 첨가시료로 매 분석 시 7번 반복 분석하여 방법검출한계 점검(8.7 방법검출한계 계산 방법 참고).
NO3 Recovery: 5μM로 농도가 동일한 NO2, NO3 용액을 매 분석마다 분석하여 카드뮴-구리 환원관의 환원효율을 점검하고 환원효율이 95% 이하일 경우 충분히 환원되지 않았다고 판단되므로 카드뮴-구리 환원관을 교체한다.
환원효율 \(= \frac{5\mu M ~ NO_{3} 분석결과}{5\mu M ~ NO_{2} 분석결과}~~~ \times 100\) (%)
분석 전 환원용액의 결과를 알기 어렵기 때문에 NO2,NO3의 gain값 및 std A 표준용액의 peak 높이(%)를 관찰한다. peak가 이전에 비해 낮아지고, gain이 높아졌다면 이전에 비해 환원율이 떨어졌다는 의미로 카드뮴-구리 환원관을 교체 후 시료를 분석한다.
QC: 안정성이 뛰어난 표준물질 여러 종류를 매 분석마다 3번씩 반복 분석하여 분석 정밀도를 계산한다(8.2.3). 농도가 검증된 인증 표준물질을 이용할 경우 3번 반복 분석한 결과로 분석 정확도(8.2.2)를 계산하여 분석 품질을 평가하고 관리할 수 있다.
Cup: 시료를 sampler의 rack에 배치한 후 sampler rack의 번호를 입력하는 칸. cup 번호를 정확히 입력해야만 올바른 시료를 sampler가 흡입할 수 있다.
1.1.1.1. Channel : 각각의 channel을 선택하면 각 channel에 할당된 분석방법 (method), baseline, drift, carryover correction등의 실행 여부를 프로그램에서 자동적으로 선택할 수 있다. 검정곡선에 사용되는 용액의 농도(calibrants 1~10), 검정곡선 fitting의 종류, 신호의 순간적인 변동(noise)에 의한 오차를 줄이는 smoothing, peak determination window time 등을 설정한다. 일반적으로 질산이온, 아질산이온, 인산이온, 용존실리카 등은 smoothing을 0으로 설정하여 분석한다. 그러나 암모늄이온은 smoothing을 8로 설정한다(JAMSTEC, Coverly recommendation). 각각에 대한 자세한 설명은 기기 매뉴얼을 참고한다.
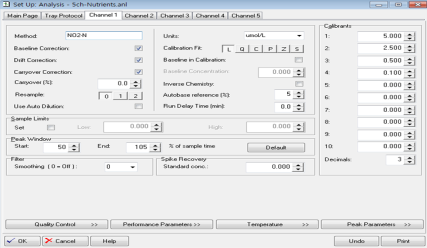
1.1.1.1. 위의 창에서 채널별로 설정을 모두 완성한 후 OK를 클릭하면 Main 창의 analysis 칸에 기입한 이름(분석명.anl)으로 저장된다. 추후 분석 시 Set up - Analysis 항목에서 저장된 Analysis file을 선택하거나 위의 system 창 좌측하단 분석명이 있는 곳을 더블 클릭하여 기존에 작성된 파일에서 sample table 등을 포함한 기타 수정사항을 변경하여 사용한다.
3.9.2.2 제조한 시약 연결 및 baseline 확인
1.1.2.1. 9.1.3의 상태에서 흡광도 값이 5%를 벗어나면 set base를 클릭하여 baseline을 5%로 맞춘다(UPW baseline). 기기 내부 공기방울 패턴이 일정한지 확인한다. 시스템 창에서 charting button아래에 있는 체크표시를 눌러 water check를 실시한다. water check 실시 동안에 charting창을 닫아도 되는지, 기기의 램프 덮개가 닫혀있는지 묻는 창이 나타나면 OK를 눌러 water check를 실시한다. water check동안에 램프의 정상작동여부, 공기방울 패턴, 램프 에너지 상태 등을 확인한다. water check 결과는 종료 직후 눈으로 확인할 수 있고 프린터를 할 수도 있다. water check 결과는 30개까지 시스템 내부에 저장되고, 메인창의 retrieve메뉴에서 performance log에서 확인할 수 있다. 1.1.2.2. water check 이후에 모든 창이 꺼진 상태이기 때문에 charting을 눌러 다시 분석창을 열고 baseline을 확인하고 smoothing을 다시 설정한다. 암모늄이온 분석채널은 smoothing을 8로 설정하고 나머지 채널들의 smoothing은 0으로 설정한다. 1.1.2.3. System wash solutions(Wash SDS, Wash Triton-X)에 연결되어 있던 각각의 시약 튜브를 각 분석 항목별 시약 용기에 연결하여 기기가 안정되기를 기다린다. 1.1.2.4. 발색시약으로 인해 baseline이 변한다(reagent baseline, RB). RB값이 5%를 벗어나면 다시 set base를 실시하여 RB 값을 5%로 설정한다. 1.1.2.5. Gain값 설정: 표준용액열 중 가장 농도가 높은 std A용액을 1분 동안 흡입하고 초순수를 1분 동안 흡입하는 과정을 세 번 반복한다. 약 10분 후 peak가 분석창에 나타나면 시스템창의 channel을 열어 peak의 정상부분이 90%에 위치하도록 분석창을 우클릭 한 후 set gain을 실시한다. baseline과 gain 설정은 분석 범위를 설정하기 위한 단계인 동시에 시약, 분석환경 등의 변화를 관찰할 방법으로 baseline과 gain값이 일정한지 지속적인 점검이 필요하다.
3.9.2.3 시료 분석 시작 및 종료
1.1.1.1. 9.2.2의 전 과정이 끝나면 sample table에 작성한 시료 번호대로 rack(부록3 참고)에 시료를 꽂는다. rack holder에 rack을 정확히 꽂아야 sample probe가 정확히 시료를 찍을 수 있으니 유의해야한다. 해수 분석 시 sample wash solution을 초순수에서 저영양염 해수 또는 인공해수로 바꾸어 matrix effect를 감소시킨다.
1.1.1.2. 시스템창의 run을 누른 후 미리 준비 해둔 분석파일(9.2.1)을 선택한다.
1.1.1.3. 시료분석이 완료된 후 baseline이 안정화되어 분석창이 자동으로 꺼질 때까지 기다린다. 만약 마지막에 baseline 불안정하여 분석이 자동으로 종료되지 않으면 강제로 분석을 종료를 하고 재계산을 통해서 자료를 회수한다.
3.9.2.4 분석종료 후 처리
1.1.1.1. 분석종료 후에는 카드뮴-구리 환원관 밸브를 닫고 시약에 꽂아두었던 시약튜브를 빼서 증류수를 담은 병에 꽂아 장비의 manifold를 세척한다. 1.1.1.2. 약 1시간 정도 씻은 후 시약튜브를 닦아 호일로 감싸 기기의 manifold속 용액을 모두 비운다. 1.1.1.3. 시스템창의 stop을 눌러 분석창을 닫은 후 분석기기와 sampler의 전원을 끄고 펌프덮개를 열어 펌프튜브의 손상을 방지한다. 1.1.1.4. 사용한 시약병/부피플라스크 등은 씻어 다음 분석 시 사용될 수 있도록 준비한다(세척순서 : 초순수 – 10% 염산 – 초순수 3번 – 건조).
3.10 자료 분석 및 계산
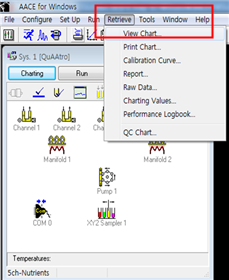
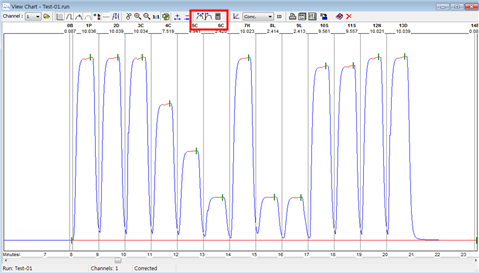
1.1. 분석이 완료되면 retrieve - view chart를 클릭하면 분석한 파일 이름을 선택할 수 있고 파일을 선택하면 아래 그림과 같이 피크가 나온다. 모든 분석결과에 대해 아래 빨간색 박스로 표시된 부분을 눌러 피크의 위치를 조정한다. 피크위치를 설정할 때는 peak window에서 일정한 위치를 선정하여 일관성을 유지하도록 한다. 박스안의 계산기 버튼을 눌러 농도를 재계산한다.
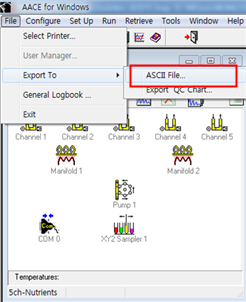
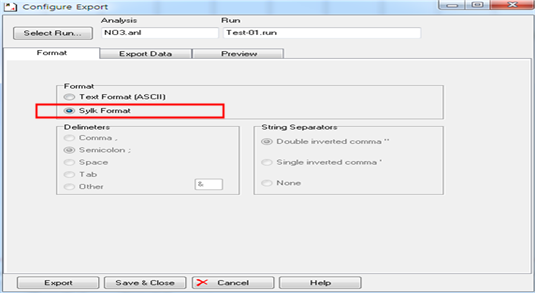
1.1. 엑셀을 이용하여 자료를 재계산할 경우 [file] - [export] - [ASCⅡ file] - chart를 선택 후, sylk format으로 내보낸다. 파일은 설정한 경로에 excel파일로 저장된다.
1.1. 시료 분석값이 검량곡선에 사용된 가장 높은 표준용액열 보다 높은 경우 시료를 희석하여 재분석한다.
3.12 부록 1. 영양염 자동분석기(QuAAtro)의 장비구성과 기능
3.12.1 측정원리
연속흐름분석법(CFA, Continuous Flow Analysis)은, 분석관 내부에 일정량의 시약과 시료를 주입하고 공기를 규칙적으로 주입하여 분절하면서 시료와 시약을 잘 혼합하여 발색시켜 flowcell이 장착된 비식계로 흡광도를 측정하여 농도를 결정한다.
3.12.2 장비구성 및 기능
3.12.2.1 Console(콘솔, 본체)

분석항목 - Channel 1: PO4-P Channel 2: NO2+NO3-N, Channel 3: NH4-N, Channel 4: SiO2-Si, Channel 5: NO2-N
3.12.2.2 펌프
3개의 proportional pump로 각각의 펌프는 시약 및 시료를 분석관에 주입 할 수 있는 튜브를 10개씩 부착한다. 각각의 펌프는 펌프튜브를 눌러주는 platen과 12개의 롤러로 구성되어 있고 펌프가 한 바퀴 회전하는데 12초가 걸린다.
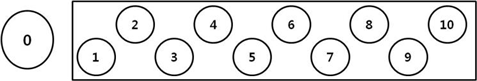
3.14 부록 3. Sample rack position
3.15 부록 4. 시료사이 공기수축(Inter Sample Air Compression, ISAC)
시료 간 공기수축(ISAC)은 자동시료주입기에서 시료 흡입을 마친 후 다음 시료를 흡입 할 준비를 위해서 세척액으로 이동할 때, 그리고 세척을 마친후 다음 시료로 이동하는 동안 흡입된 공기방울이 펌프롤러에 눌리면서 시료주입 튜브 내 압력이 대기압과 유사하거나 약간 낮아져 발생하는 현상이다. 시료주입 튜브 내 압력이 감소하면서 눌려진 공기방울 앞쪽의 시료 흐름이 순간적으로 감소하고 시약과 혼합되는 시료의 부피가 감소된다. 결과적으로, 이러한 압력의 변화로 정상적일 때 보다 적은 양의 시료가 주입되어 농도가 낮은 구간이 발생한다. 따라서 긴 시료를 흡입 할 경우 다이어그램에 표시된 것처럼 시료피크 정상의 끝부분에서 피크가 움푹 파인 모양이 나타난다.

움푹 파인 정도가 크거나, 피크의 중간부분에 위치할 경우 분석결과의 정확도가 떨어진다. 이를 방지하기 위해 펌프와 시료주입 피팅 사이의 시료주입 튜브 의 길이를 조정하여 ISAC구간을 피크정상에서 벗어나 피크의 시작부분이나 끝부분에 위치하게끔 조절해야한다. ISAC구간을 계산하는 방법은 다음과 같다. 공기방울이 펌프를 지나 주입피팅에 도달하는데 걸리는 시간이 시료 당 분석 소요시간(시료주입+세척시간)보다 약 2~8초(목표는 3초) 짧아야한다. 현재 한국해양과학기술원에서 시간당 시료분석 개수는 60개이고, 자동 시료주입구의 시료와 세척의 시간 비는 3:1이다.
- 시료주입:45초
- 세척시간:15초
- 시료 당 분석 소요 시간: 60초
따라서 펌프와 주입피팅 사이의 이동 시간은 52~58초(목표는 57초)이다.
시료주입 튜브 길이 조정 방법
가. 펌프에서 시료주입 피팅 사이의 시료주입 튜브의 길이를 충분히 길게 준비한다.
나. 기기를 동작시키고 시료 간 공기방울이 펌프를 지날 때 자세히 살핀다.
다. 공기방울이 펌프를 벗어나는 것이 보이는 순간은 공기방울이 펌프롤러를 지난 후 이미 2초 경과한 상태이다. 목표한 시간까지 계속 시간을 측정한다(시계가 없을 경우에는 공기밸브가 2초마다 작동하므로 이를 이용하여 시간을 측정할 수 있음). 목표로 한 시간에 공기방울 위치를 시료주입 튜브에 표시한다.
라. 펌프 동작을 멈추고 시료주입 튜브를 자르고 주입피팅에 연결한 뒤 펌프를 작동시킨다.
마. 만약 튜브의 적정 길이가 너무 짧아 주입피팅까지 도달하지 않으면 목표시간을 한 번 더 더해줄 수 있다.
Double ISAC = 목표시간 +시료주입시간+세척시간
= 57초 + 45초 + 15초 = 117초